Bio Mater. │基于聚合物纳米颗粒的用于脑型疟疾的诊断试剂、治疗药物及疫苗的开发
脑疟疾是一种臭名昭著的恶性寄生虫病,已导致大部分发病率。根据世界卫生组织 (WHO) 的数据,它每年在全球造成约2.28 亿新感染和近 4

脑疟疾是一种臭名昭著的恶性寄生虫病,已导致大部分发病率。根据世界卫生组织 (WHO) 的数据,它每年在全球造成约2.28 亿新感染和近 450,000 人死亡。尽管已经考虑了大量的策略和方法来对抗它,但今天它仍然是全球健康负担(图1)。疟疾是由疟原虫种类、间日疟原虫(最常见)、恶性疟原虫(最致命的种类)、疟原虫(危害较小)和卵形疟原虫的传播引起的,这些疟原虫属于顶复门。根据世界卫生组织的数据,包括非洲和印度在内的发展中国家的人群主要是疟疾流行病,最容易感染这种疾病,有近91%的病例,其中 86%是孕妇和 5 岁以下的儿童。间日疟原虫的死亡率低于恶性疟原虫,它在巴布亚新几内亚、亚洲、南非和大洋洲等国家具有巨大的社会经济影响。另一方面,寄生虫基因组的多样性在不同地区之间存在显著差异。全基因组关联研究 (GWAS) 表明,遗传异质性与地理直接相关,疟疾寄生虫可以根据大陆人口聚集(寄生虫来自亚洲、非洲、柬埔寨、泰国-柬埔寨、泰国和美国)。在疟疾流行地区,对于一名孕妇,与疟疾预后和治疗相关的总成本从3.2美元到 54 美元不等。在印度中部,每户家庭的价格从 19 美元到 35 美元不等。不幸的是,疟疾仍然被视为一种被忽视的疾病,几乎没有治疗选择和配方,市场上也没有疫苗。
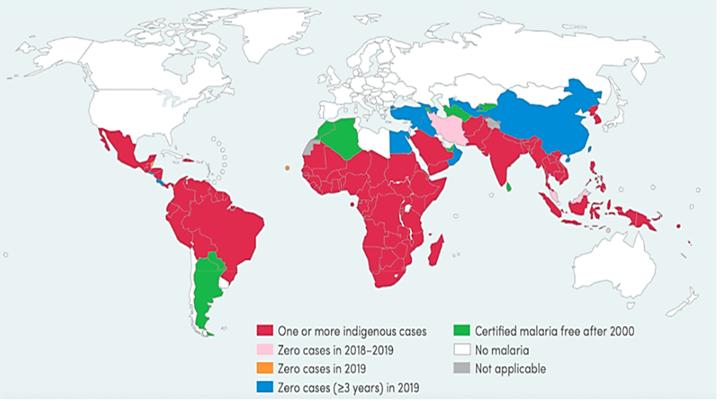
图1. 2000-2019 年全球疟疾病例和死亡人数估计,世界卫生组织《2020 年世界疟疾报告》(来源:ACS Applied Bio Materials)。
巨大的死亡率是由于疟原虫复杂的生命周期,如图2所示。疟原虫具有内在的生物钟,它们能够与体温的周期性波动同步。感染始于雌性按蚊叮咬,将疟原虫以子孢子的形式(存在于唾液腺中)注射到血液中。然后这些子孢子移向肝脏。在恶性疟原虫和间日疟原虫的情况下,一个子孢子分别能够产生约 30000 和 10000 种新寄生虫。然后它经历7-10天的无性繁殖,形成数千个裂殖子。这些裂殖子进入红细胞(RBCs),静置10-15小时,形成环状阶段。此外,它们在接下来的25小时内经历快速生长期并达到滋养体阶段。感染48 h后,晚期滋养体在细胞裂解前分裂数次,释放出新形成的裂殖子,继续进入新的循环。这种裂解会导致不同的疟疾症状,如体温周期性升高(每 48-72 小时)、头痛、脾肿大、贫血等。一些裂殖子形成新鲜的裂殖子,这些裂殖子成熟为雌性和雄性配子体并在血液。这些配子体在叮咬感染者时被按蚊带走。通过有性繁殖,它们形成数千个子孢子。这些子孢子然后传播到蚊子的唾液腺。当蚊子叮咬另一个人时,感染周期再次开始。脑型疟疾,表现为脑血管血流阻塞等神经系统症状,是由恶性疟原虫引起的严重感染引起的。由此产生的结果是血管堵塞、脑水肿、颅内高压水平升高等等。血管内寄生虫会导致脑损伤,最终,当感染严重时,会导致死亡。
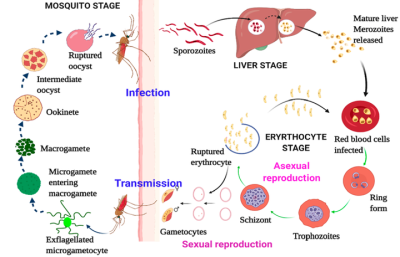
图2. 恶性疟原虫生命周期重要阶段的代表图(来源:ACS Applied Bio Materials)。
已经开发了几种抗疟疾药物,例如磺胺喹、伯氨喹、氯喹和乙胺嘧啶,以及用于病媒控制的杀虫剂。这些药物被大量使用,随后寄生虫对其产生抗药性,它们会产生毒性作用,如奎宁引起的低血糖,葡萄糖-6-磷酸脱氢酶(G6PD)缺乏症患者因伯氨喹引起的溶血毒性,甲氟喹引起的神经精神毒性和氟泛群引起的心脏毒性等。已经引入了联合疗法进行治疗,例如,青蒿素为基础的疗法(ACTs)和非青蒿素为基础的疗法,进一步遇到了耐药性并引起副作用,例如ACT的作用方式不明确、高剂量引起的神经毒性、致畸性和伙伴药物的半衰期短。这些限制进一步需要治疗疟疾的替代药物。传统的给药方法也会引起许多副作用,例如高血压、胃肠道反应、炎症、头痛、胃痛和视力模糊。游离药物双氢青蒿素显示出低生物利用度、短半衰期和低稳定性并且在很长一段时间内不能在血液中获得。为了克服这些困境,研究人员正在尝试开发基于纳米粒子的治疗模型。然而,找到合适的纳米粒子来靶向受感染的红细胞是最大的挑战。在不同形式的载体中,聚合物纳米载体目前表现出最有希望的治疗效果。使用具有不同形态和大小的天然或合成聚合物在微生物传染病领域,特别是疟疾领域,具有提高的生物相容性和生物利用度、增强的渗透性、更好的保留时间和更低的毒性,已获得突出地位。聚合物载体系统,如胶束、水凝胶、树枝状大分子和聚合物-药物偶联物,也被设计用于克服耐药性和多药耐药性 (MDR) 行为。由于组合治疗药物递送系统,可以实现所需的药物释放曲线、药效学和药代动力学行为。
最近的几篇综述文章很少关注聚合物纳米粒子,脂质、蛋白质、核酸和金属纳米粒子,水凝胶、胶束和用于负载抗疟药物用于疟疾治疗的树枝状聚合物。一些关于用于传染病(如 HIV 和其他病毒感染)的聚合物的文章包括疟疾,其中讨论仅限于一段。很少有关于聚合物纳米颗粒的评论仅限于“青蒿素及其衍生物”,和载有抗疟药物或其他药物的金属、聚合物、量子点和肽/蛋白质载体等递送系统被限制在一个或两个段落。令人惊讶的是,上述评论都没有集中在用于疟疾诊断或疫苗接种的聚合物上,也没有严格关注脑型疟疾的治疗、相关挑战和治疗的未来方向。因此,非常需要突出该领域的洞察力,包括新的功能性聚合物纳米材料(结构、中空、多孔、尺寸、形状等)在纳米医学中的作用以及用于治疗脑疟疾的已开发机械方法。有一些关于疟疾疫苗开发的综述可供参考,这些综述已经讨论过了。已在感染的不同阶段测试过的一般疫苗接种方法使用烟草花叶病毒平台、前红细胞阶段、传播阻断阶段、基于蛋白质的疫苗接种和基于子孢子的疫苗接种。值得注意的是,早期的评论都没有讨论用于开发预防脑疟疾的疫苗的聚合纳米材料。总之,据我们所知,没有一篇评论讨论过使用聚合物纳米粒子制成的疟疾诊断工具或设备。
在此背景下,本综述重点关注用于开发新的诊断策略、纳米药物和疫苗以控制脑型疟疾的聚合纳米材料或纳米胶囊。集体信息将指导科学界进一步开发药物和治疗程序。在第一节中,我们讨论了抗疟疾药物递送和疫苗开发所采用的各种方法,以及它们从疟疾治疗的体外或体内评估中获得的治疗效果。在第二部分中,我们重点介绍了在治疗脑型疟疾的框架下使用 3D 模型器官进行的各种专利报告和合适的动物试验。在这里,我们将这篇综述集中在聚合物材料和聚合物纳米载体上,如纳米胶囊、纳米颗粒、基于磁性纳米颗粒的聚合物复合材料、刺激响应嵌段共聚物、基因传递、聚合物-药物偶联物和联合疗法,这些药物从未一起用于治疗疟疾。
2. 基于聚合物纳米颗粒的疟疾诊断
用于诊断的聚合物纳米粒子应满足一些基本要求,例如(i)均匀行为的窄尺寸分布,(ii)在所需的 pH 值、温度和离子强度下的稳定性,以及(iii)固定化生物探针的活性保留。对于疟疾的检测,有许多诊断工具可供使用;然而,每种诊断策略都有其自身的优点和缺点。重要的诊断策略主要依赖于诊断疾病的创新和有效的想法。据报道,流体动力学尺寸约为349 ± 21 nm的单分散聚(苯乙烯-共 - 丙烯酸)(St/AA)可用于诊断疟疾,其中该共聚物与恶性疟原虫抗原或抗疟原虫抗体的粗提物物理吸附。恶性疟原虫,即生物探针。将 St/AA 抗原结合颗粒(免疫胶乳)与感染恶性疟原虫的血浆一起孵育后,在光学显微镜下观察到免疫凝集颗粒。后来,通过三种不同的方法将有色 St/AA(流体动力学尺寸 ∼99.7 ± 0.4 nm)胶乳与人恶性疟原虫多克隆 IgG 抗体偶联,所有方法均显示 100% 的灵敏度。金纳米粒子还用线性二嵌段共聚物(聚(N-异丙基丙烯酰胺)和 N,N-二甲基氨基乙基丙烯酰胺)进行了功能化,该共聚物与链霉亲和素结合,并与生物素化的 IgG 抗体进一步共修饰。这些金纳米粒子抗原用于检测加标混合血浆中的疟原虫。还开发了基于阳离子聚合物如聚(二烯丙基甲基氯化铵)和聚(烯丙基胺盐酸盐)的金纳米粒子介导的适体传感器。与多克隆 IgG 抗体化学结合的多糖涂层超顺磁性 (Fe3O4) 纳米颗粒用于分离含有特定抗原的疟原虫。显微结果表明,从血液中分离出不同阶段的恶性疟原虫,纯度高。使用 FDA(美国食品和药物管理局)批准的吲哚菁绿 (ICG) 荧光染料制备 PEG 化(聚(乙二醇))脂质体,用于治疗和诊断脑型疟疾。对于 PEG 化 ICG 脂质体,与 CM 处理小鼠脑中的游离脂质体相比,发射强度增加。根据恶性疟原虫乳酸脱氢酶 (Pf-LDH) 和间日疟原虫乳酸脱氢酶 (Pv-LDH) 蛋白的浓度,颜色会发生变化。这些适体传感器已显示出非常低的检测限。 Omar 和他的团队开发了一种化学分析技术,使用廉价且稳定的非生物试剂(如可溶性疟原虫)来催化 N-异丙基丙烯酰胺 (NIPAM) 的自由基聚合,并且 pNIPAM 溶液的颜色会在寄生虫存在时发生变化。然而,通过这种方法,由于浑浊的形成,通过光学测量定量检测寄生虫感染变得困难,并且系统难以准确检测感染。PEG 和适配体-PEG 薄膜也用于抑制人血清对电化学疟疾适配体传感器的非特异性结合。然而,与疏水性烷硫醇相比,PEG 对基质生物污染的抵抗力明显更高。此外,PEG可以帮助提高检测限和复杂基质耐受性,而不影响适体传感器的灵敏度。
3. 基于聚合物纳米载体的抗疟药物递送系统
为了克服预防性抗疟疾药物自行给药的不规律性,基于纳米载体或载体的制剂发挥着重要作用。根据这一点,可以将它们装载或封装在聚合物载体中,而不是给予游离药物,以提供更好的稳定性并提高低剂量治疗的有效性,以及最大限度地减少副作用。因此,基于聚合物纳米颗粒的抗疟药物递送可导致 (i) 剂量减少,特别是确保细胞内靶向、降低毒性、高药物有效载荷和免疫原性,保护药物免于细胞外降解,并选择性地将它们转运至疟原虫,以及(ii) 改善抗疟药的药代动力学或药效学特征,其作用期应少于使用刺激反应载体给药的抗疟药混合物。此处重点介绍的不同聚合物纳米载体可列为纳米球、脂质体、树枝状大分子、胶束和水凝胶或纳米凝胶。下面讨论一些这样的方法。
疟疾药物治疗的主要目的是在寄生疟原虫的细胞内寄生空泡中诱导高药物浓度。寄生虫存在于红细胞内,为了接近寄生虫内的目标,携带者必须穿过多个膜或屏障。遇到的膜的顺序是宿主细胞膜 (HCM)、寄生液泡膜 (PVM)、寄生虫质膜 (PPM) 和食物液泡膜 (FVM)(图3)。管泡膜 (TVM) 起源于PVM并延伸至RBC膜。上述细胞内隔室的pH值差异有助于使用pH敏感纳米载体递送抗疟药物。尽管迄今为止通过纳米载体将抗疟药物递送至受感染的红细胞的机制尚不清楚,但这里描述了两种建议的机制,(i)新的渗透途径(NPP)和(ii)传统的序列途径。第一种机制是基于疟原虫感染后(12-16小时)在宿主红细胞上形成通道或孔。这些通道被称为“新的渗透途径”,它们有助于区分受感染的红细胞和未受感染的红细胞。由于TVM 靠近 NPP,尺寸 < 80 nm 的纳米载体可能会直接沉入受感染的红细胞,并与其内容物一起渗透到红细胞内。
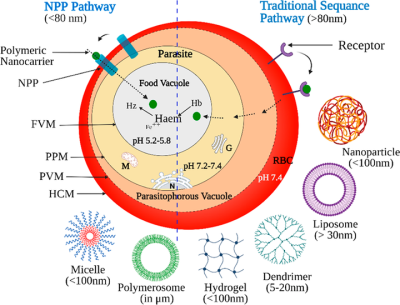
图3. 被感染的红细胞(NPP途径和传统序列途径)和不同聚合物载体的标准尺寸范围的两种拟议药物吸收机制的图解表示。缩写:G,高尔基体; Hb,血红蛋白;赫兹,血红素; Fe,铁离子; M,线粒体; N,核;红细胞,红细胞; HCM,宿主细胞膜; PVM,寄生液泡膜; PPM,寄生虫质膜; FVM,食物泡膜; NPP,新的渗透途径(来源:ACS Applied Bio Materials)。
第二种机制基于传统的膜融合,即载药纳米载体直接与受感染的红细胞(iRBC)融合。这两种机制之间的主要区别在于NPP绕过RBC的胞质溶胶,而在第二种情况下,制剂通过 iRBC的胞质溶胶。
3.1. 用于疟疾治疗的聚合物纳米颗粒和纳米胶囊
纳米尺寸的颗粒可以轻松穿过生物屏障,提高细胞吸收并轻松将药物材料运送到目标部位,如肝脏、大脑和实体肿瘤。与脂质体类似,其他聚合物纳米制剂,如纳米胶囊、纳米颗粒和纳米乳液,是药物输送系统研究最多的载体。聚合物纳米制剂的尺寸可达1000 nm,由一种生物相容性聚合物组成,药物分子可以在其中非常安全地吸附、截留或封装。
3.1.1. 基于聚合物纳米粒子的纳米药物
天然或合成来源的可生物降解和生物相容性聚合物纳米粒子能够捕获治疗分子。这些颗粒的稳定性可以根据所需的药物递送动力学和机制进行调整。莫能菌素是一种羧基聚醚离子载体,被封装在不同分子量的聚乳酸-乙醇酸共聚物 (PLGA) 纳米颗粒中,具有双相释放动力学,即初始爆发释放然后持续释放行为。与游离莫能菌素给药相比,抗疟活性提高了10 倍。姜黄素与三聚磷酸五钠和壳聚糖纳米颗粒的配方可以增强细胞摄取。与小鼠血浆中游离姜黄素给药相比,该制剂的体外研究表明其降解较晚,并且该制剂在约氏疟原虫菌株中的体内抗疟试验表明它能够通过完整的粘膜屏障。设计了一系列以盐酸甲氟喹作为抗疟药的纳米制剂和聚己内酯(PCL)纳米颗粒,主要通过一级、零级、Korsmeyer Peppas 模型、Higuchi 和 Hixson Crowell 模型检查药物释放动力学。 .这些纳米制剂表现出持续释放并导致体外抗疟活性。青蒿素也用聚乙烯醇 (PVA; ξ ≈ 16.3–27.2 mV) 包裹在 PCL 中 (99.93%),通过在24小时内释放药物分子实现了有希望的抗疟活性。这项工作进一步报道,可以通过改变 PCL 和 PVA 的比例以及青蒿素-HCL 来控制剂量。使用聚(甲基丙烯酸丁酯-共-吗啉代乙基磺基甜菜碱甲基丙烯酸酯) (PBMA-MESBMA) 合成了自组装的两性离子聚合物纳米粒子。这些聚合物纳米粒子可以包裹姜黄素和抗疟疾药物,并可以通过穿透肠上皮进行口服给药。
通过这种配方,小鼠血液中的姜黄素浓度通过口服给药增加。此外,在实验性脑疟疾模型中,与天然姜黄素相比,纳米配制的 PLGA-姜黄素纳米颗粒显示出更好的治疗指数。这些制剂即使在较低浓度下也能抑制大脑中感染的红细胞和 CD8+ T 细胞的隔离。它还表现出更好的生物学可用性以及预防神经系统症状和延迟小鼠死亡。设计了一种 PCL-MPEG(甲氧基聚(乙二醇))纳米颗粒并装载了青蒿素来治疗脑型疟疾。体内结果表明,伯氏疟原虫 ANKA 感染的 C57BL/6小鼠的药代动力学行为、抗疟原虫活性和抗炎作用得到改善。
3.1.2. 聚合物纳米胶囊 (NCs) 和纳米药物
纳米胶囊是一种胶体药物载体系统,由一个油性核心和一层薄的聚合物膜组成,其中可以截留生物活性化合物。负载在涂有 PEG (20 kDa)(总 d ≈ 150–250 nm)的聚乳酸(PLA)NC 中的卤泛群(Hf)用于疟疾治疗,并表现出改善的药代动力学和较低的毒性。此外,Hf NCs 对血清蛋白的亲和力相对较高,并且制剂表面存在的 PEG 链通过提供亲水性空间屏障阻碍了 Hf 的释放,并显示出可控的释放行为。然而,溶解在 PEG-二甲基乙酰胺中的 Hf 被证明是有害的。此外,封装在壳聚糖 NC 中的抗菌药物三氯生也表现出对恶性疟原虫的有效杀灭作用。奎宁 (QN) 被封装在由 PCL 和 200 nm 大小的聚山梨醇酯80组成的NC 中。 P. berghei-Wistar 大鼠实验模型的体内实验显示出良好的药代动力学和药效学行为,存活率也明显提高。奎宁和姜黄素被封装在聚山梨醇酯80涂层 PCL 纳米胶囊中,并针对 W2 和 3D7 恶性疟原虫菌株进行了测试,显示出增强的活性和最小的毒性。青蒿琥酯-肝素缀合的纳米胶囊被设计用于青蒿琥酯的细胞内递送。体外结果表明,在中性生理条件下,释放率较低(33.81%),而在酸性条件下(如寄生虫食物泡),释放率非常高(92.74%)。
3.2. 用于疟疾治疗的基于脂质体的纳米药物
由于胶体药物载体(如乳液)的适应性,脂质体正在引起人们对抗疟药物递送的关注。脂质体可以捕获亲水性和疏水性药物,从而降低它们的毒性。静脉注射后,脂质体很容易被脾脏和肝脏的吞噬细胞吞噬。根据目标位点,脂质体可以与趋化配体(如多糖、肽和抗体)结合,也可以与 pH 响应性脂质(如聚乙烯亚胺 (PEI)、亲水性聚乙二醇化磷脂或 PEG-肽)结合以赋予疟疾治疗体内模型的特定治疗效果和改进的性能。
例如,包覆壳聚糖(~250 nm)的奎宁包封脂质体在冷却条件下至少稳定6个月,可以释放奎宁并用于疟疾的干预。用从伯氏疟原虫环子孢子蛋白 (CSP) 的 N 端收集的 19 个氨基酸肽制备的脂质体可以有效地靶向小鼠肝脏。该制剂对肝细胞的递送效率相当高(>80%)。特别是,当这些肽与脂质-PEG系统的远端结合时,它们表现出严重的血清诱导的脂质体聚集。此外,随着PEG和 PEG-肽(CSP 蛋白N端的 19 个氨基酸)摩尔分数的变化,发现缀合的脂质体制剂可有效靶向肝细胞(Hepa 细胞)。对于静脉给药,在伯氏疟原虫感染的小鼠模型中,观察到在15分钟内,肝脏中恢复了近 80% 的总给药剂量,并且发现肝细胞摄取增加了600多-比心脏的摄取量高出1倍,比其他器官高出200多倍。
装载在聚乙二醇化脂质体中的青蒿素和姜黄素也用于疟疾治疗。聚(乙二醇)-2000-二硬脂酰磷脂酰乙醇胺(P90G)和基于胆固醇的脂质体载体非常稳定(ξ ≈ -20 mV),负载效率约为70%,并且比游离青蒿素/姜黄素更快地减少寄生虫血症以与通过 NK-65 感染的伯氏疟原虫鼠模型测试相似的剂量给药。与游离莫能菌素递送相比,用不同密度的二硬脂酰-磷脂酰-乙醇胺-甲氧基-PEG 2000 (DSPE-mPEG-2000) 修饰的PEG功能化脂质或脂质体显示出更好的抗疟原虫活性。免疫PEG脂质体也用于将亲脂性抗疟药物如氨基喹啉和氨基醇输送到受感染的红细胞。在约氏疟原虫感染的小鼠中,含有氨基喹啉的脂质体制剂可以成功地减少血液中的寄生虫血症。 (100,101) 在约氏疟原虫感染的小鼠模型中测试了两种不同形式的带有 Eudragit S100 的阴离子共聚物脂质体(Eudragit-hyluronan 脂质体和 Eudragit 营养体)与姜黄素组装在一起。在胃肠液中,营养体表现出比脂质体形式更好的结果。PEG-脂质体在使用包裹在脂质体膜中的多米芬溴化物和包裹在脂质体中的两种药物(吡咯啶和阿托伐醌)的联合治疗中也表现出显着的抗疟活性,优于这三种药物的自由给药。
3.3. 基于树枝状大分子的纳米载体
树枝状大分子被称为“21 世纪的聚合物”,是通过成核-生长过程产生的单分散聚合物,它们在药物输送方面表现出很高的效率。由于树枝状大分子内部是空的,它们可以容纳巨大的药物负载,药物降解较少,并提供控释。
由与赖氨酸缀合的PEG合成并涂有硫酸软骨素A (CSA) 的树枝状大分子在静脉内给药后用于控制和延长蒿甲醚 (ART)(一种疏水性抗疟药物)的释放。根据抗疟药的大小,它们可以通过与等摩尔CSA缀合来装载,随后装载和释放效率可以提高许多倍。涂有 CSA 有助于降低溶血性和巨噬细胞毒性。此外,CSA有助于在几个小时内清除恶性疟原虫的两个阶段、滋养体和环状阶段。
同样,负载在 CSA 包被的基于聚 (l-赖氨酸) 的树枝状大分子中的氯喹 (CQ) 在清除恶性疟原虫的滋养体和环状阶段方面表现出显着的效果。 CSA 涂层有助于 CQ 从树枝状大分子中的持续和受控释放。基于 PEG-赖氨酸-肽的树枝状大分子制剂中的伯氨喹 (PQ) 有助于在红细胞中维持较低的寄生虫感染水平。然而,尽管使用涂有 PEG-1000 并负载有磷酸氯喹的聚 (l-赖氨酸) 树枝状聚合物显示出毒性较小、吞噬作用降低、巨噬细胞,免疫原性较低。
另一方面,两亲树枝状大分子能够形成一系列超分子纳米结构,并允许抗疟药物内化到细胞中。考虑到这些事实,开发了两种用于抗疟药物递送的树枝状系统:(1) 两亲链段 Janus 树枝状大分子(由两个不同极性的树枝状嵌段组成)和 (2) 使用 Pluronic 聚合物的线性树枝状嵌段共聚物和基于 2,2-双(羟甲基)丙酸 (bis-MPA) 的聚酯树枝状聚合物。 (119-121) 生物相容性、在生物环境中的溶解性以及酶促和非酶促水解降解是 bis-MPA 的重要特征,它增强了抗疟药物的递送。在此 PQ 和 CQ用于特异性靶向疟原虫感染的红细胞(即感染了恶性疟原虫和约氏疟原虫菌株)。与 CQ 和 PQ 的游离给药相比,它们表现出较低的体外 IC50 值(低3倍和4倍)。可以注意到,百草枯在G6PD缺乏的患者中会产生溶血,这种毒理学问题限制了百草枯的使用。然而,这些树突状制剂可作为一种有前途的抗疟药,因为用于树突状生长抑制试验 (GIA) 的浓度既不溶血也不具有细胞毒性。然而,增加树枝状链的链长可以封装更多量的抗疟药物并提供不同的结果,因为这些制剂随着血液停留时间的增加而提高了药物的稳定性。此外,青蒿素与三聚体和四聚体分子共价结合,由于其在培养基中的溶解度有限(高亲脂性),与四聚体分子相比,三聚体分子的处理效率更高。合成了一种负载 CQ 的姜黄素阴离子线性球状树枝状大分子(柠檬酸-PEG-柠檬酸),平均尺寸为239 nm。这些制剂用于使用1H NMR 研究来研究恶性疟原虫的代谢组学。这些制剂在乙醛酸盐和羧酸盐样代谢循环中进一步显示出可忽略不计的毒性。
然而,与实现树枝状大分子结构相关的主要问题是在合成过程中需要使用交联剂,并且大多数交联剂本质上是有毒的。此外,已知的天然存在的生物相容性交联剂非常少并且在许多情况下是无效的。因此,交联剂的选择对于设计可用于制备治疗脑型疟疾的纳米药物的树枝状大分子至关重要。
3.4.基于胶束的给药系统
对于疟疾治疗,胶束由两亲嵌段共聚物(具有疏水和亲水链端)的自组装制成。由于胶束中存在亲水链,它们有助于增加血液循环时间并提供抗疟药物的持续释放。这进一步由用于制造胶束的聚合物类型的临界胶束浓度 (CMC) 控制。可以注意到,较低的 CMC 值更适合抗疟药物的输送。用于疟疾治疗的由生物相容性和可生物降解聚合物(包括 PEG、mPEG、PCL、PVP 及其嵌段共聚物)制备的许多胶束及其大小和封装药物列于表1。
表 1. 用于抗疟药物递送的聚合物胶束列表
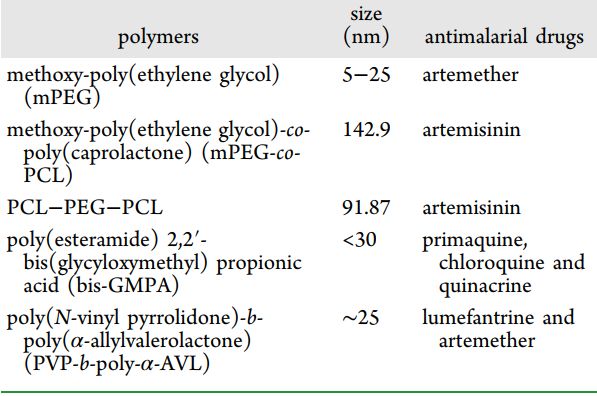
由mPEG组成的胶束负载蒿甲醚并显示出抗疟活性;然而,该配方的主要缺点是胶束载体降解缓慢,最终对测试系统有毒。后来青蒿素被包裹在mPEG-co-PCL中以获得缓释。 Manjili 和他的同事合成了基于 PCL-PEG-PCL 的胶束,据报道这些胶束具有抗疟原虫作用(体内)。可以注意到载青蒿素的胶束与其自由给药相比增加了药物在血液中的循环以及治疗效果。甘氨酸修饰的双-MPA(甲基丙酸)以两种形式使用(树枝状超支化分子 DHP 和杂化树枝状-线性-树枝状嵌段共聚物 HDLDBC)和基于聚(酯酰胺)的新型树枝状配方 2 ,2'-双(甘氨酰氧基甲基)丙酸 (bis-GMPA) 用于封装 PQ、CQ 和奎纳克林。所有这些制剂都表现出高载药能力以及对受感染红细胞的有效靶向。设计了一种自组装的可生物降解的二嵌段共聚物 PVP-b-PAVL 胶束并将其连接到苯芴醇上。最后,该组件包埋了第二种药物分子(即蒿甲醚),所得制剂用于疟疾的联合治疗。尽管与自由递送苯芴醇和蒿甲醚以组合模式相比,这些制剂显示出较少的药物释放,但发现通过将这两种药物包封在聚合物胶束中可以降低毒性。
3.5. 基于纳米凝胶的疟疾药物
生物安全聚合物水凝胶具有3D网络结构,可以吸收溶剂。这些是非免疫原性的、易降解的、无毒的,并且本质上对刺激敏感。水凝胶的这些特性使其可用于生物医学领域,例如组织再生、药物输送、诊断等。
为了更长时间地提高生物利用度,负载姜黄素的羟丙基甲基纤维素 (HPMC) 和 PVP 水凝胶显示出显着的抗疟活性潜力。由果胶(一种多糖)基质制成的基于水凝胶的透皮贴剂也可以装载 CQ。在体内大鼠模型中,观察到与静脉内给药相比,该贴剂可以显着释放 Na+ 离子。后来,这种水凝胶的改良形式在氯喹果胶基水凝胶中与乙酸 (AA) 一起配制。这些透皮贴剂可以很容易地释放 AA,从而显著降低寄生虫血症。一种称为阿拉伯树胶的杂多糖被用作双重抗疟药物载体(4-氨基喹啉和姜黄素)。根据水凝胶的交联剂,可以控制不同的药代动力学行为。大豆分离蛋白-Carbopol-聚丙烯酰胺基水凝胶负载氯喹二磷酸盐和姜黄素在 pH 7.4 时表现出增加的溶胀行为,一项体外研究表明,与姜黄素相比,氯喹的释放速度要快得多。此外,体内结果表明在减少寄生虫血症方面有很大的潜力
制备由聚山梨醇酯80、油酸和癸二酸二丁酯组成的溶致液体预浓缩物,其中溶解了 ACT 衍生物如苯芴醇和蒿甲醚。向该溶液中添加 PLGA 有助于使水凝胶的强度增加 3 倍,从而显示出持续释放。密度泛函理论 (DFT) 用于研究三种不同抗疟药(氯喹、伯氨喹和阿莫地喹)与基于水凝胶的丙烯酰胺二聚体和三聚体分子在水和真空环境中的理论相互作用。通过自然键轨道计算观察到强电荷转移,相互作用程度为氯喹<阿莫地喹<伯氨喹。这导致了第一种合理设计受控抗疟药物递送的方法。可以注意到,溶胀行为、抗疟药物的负载程度及其释放、网络降解的性质和抗疟治疗效率可以受到水凝胶的化学结构和功能性的强烈控制,这进一步可以通过正确选择用于设计水凝胶的“mers”和交联剂来控制。亲水性和疏水性主要控制静电相互作用的程度以及加载和释放的量,从而进一步控制抗疟药物的给药剂量。
3.6.用于疟疾治疗的刺激响应性聚合物纳米载体和纳米药物
刺激响应(光、磁、机械、超声、温度、电刺激、化学物质(例如,溶剂、电化学、离子强度和 pH)或生物制剂(例如,受体、酶或葡萄糖))聚合物大多是两亲性嵌段ABC型共聚物,广泛用作药物输送载体或载体。一般来说,ABC 型共聚物由两个具有不同化学结构的独立部分组成,它们经历相分离。由于链缔合过程,选择性地将一个嵌段溶解在特定溶剂中。结果,形成了具有核/壳结构的纳米级敏感聚合物胶束。疏水和亲水嵌段与周围介质之间的相互作用形成胶束ABC型自组装的基础。胶束化后,疏水核作为疏水药物的储存空间,可以化学、物理或静电封装。亲水壳有助于稳定疏水核,该壳充当疏水区域和本体水相之间的边界。
ABC 型热敏聚合物纳米粒子对治疗疟疾非常有用,因为它具有许多特性,例如低 CMC、与脂质体相比具有更好的机械稳定性、在同一系统中使用刺激响应材料的可能性以及靶向部分的修饰。通过添加聚酯、聚磷酸酯或多肽如 PCL,可以增强 ABC 型聚合物的生物降解性。对新的抗疟药或对抗产生耐药性的方法的需求已得到广泛认可。一种克服耐药性发展的建议系统是基于刺激敏感聚合物纳米颗粒的高浓度抗疟药物递送。
尺寸减小的聚合物纳米颗粒是必不可少的,因为有效靶向 iRBC 中细胞内疟原虫所需的尺寸约为80 nm。使用 PEG 替代物 poly(2-甲基-2-恶唑啉)(PMOXA)。这些还原响应ABC型纳米颗粒由疏水性PCL和亲水性PMOXA通过接枝技术组成,以实现聚(2-甲基-2-恶唑啉)-接枝(SS)-聚(ε-己内酯)(PMOXA-g(SS) -PCL) (图4b) 通过在 PMOXA 和 PCL 之间形成二硫键连接器。这种二硫键本质上是氧化还原反应的。然而,氧化还原响应性聚合物纳米粒子具有广泛的应用和不同的低分子量生物分子、药物和核酸的传递机制。除此之外,二硫键的断裂在细胞摄取后迅速发生,还原性纳米颗粒在胞质溶胶中发生分解,这有助于释放治疗寄生虫血症所需的药物。
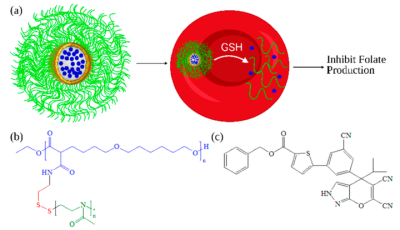
图4. 通过基于还原响应性两亲嵌段共聚物 (ABC) 的水性自组装将药物输送到疟原虫感染的红细胞 (iRBC) 的代表图。 (a) 使用还原响应性 PMOXA-g(SS)-PCL 纳米粒子将 SHMT 抑制剂 (±)-1 递送至 iRBC 的示意图。 (b) PMOXA-g(SS)-PCL 和 (c) SHMT 抑制剂 (±)-1 的化学结构(来源:ACS Applied Bio Materials)。
然而,当溶液相中的粒径范围为 30–50 nm 且剂量高达 1 mg/mL 时,这些基于 ABC 的系统可提供更好的结果。在该系统中,通过添加 GSH(谷胱甘肽)来控制(较慢)释放程度。此外,该系统控制细胞内条件,就像其他许多维持细胞溶质还原潜力的蛋白质和酶一样。值得注意的是,谷胱甘肽是一种抗氧化剂,主要由三种氨基酸组成,谷氨酰胺、甘氨酸和半胱氨酸,通常在细胞中产生。然而,当抗疟药与这些载体一起给药时,它对寄生虫的两个生命周期都有效。基于PMXA的纳米颗粒由于其化学性质和降解行为而在血液中显示出延长的循环。该系统的疏水核心充当药物的保护措施,并在到达 iRBC之前保护其免受外部生物环境的影响,这是游离 SHMT 抑制剂 (±)-1 的一个有希望的案例。使用这种制剂 [SHMT 抑制剂 (±)-1 负载的 PMXA-g(SS)-PCL](图4)的主要优点是更快和更有效地释放候选药物以对抗耐药性恶性疟原虫与药物敏感菌株的比较(图4a)。
2018 年,我们设计了一种中空介孔 PCL 基温度响应纳米胶囊,其中装载了抗疟药物。这些聚合物制剂基于时间-温度机制将药物(DHA/CQDP)输送到感染了恶性疟原虫的红细胞(图5a)。这些制剂可以有效地释放负载的 DHA/CQDP,并随着体温的升高而精确剂量,而当体温降至 37.4°C 时,剂量的递送最小化,如图5b、c 中的示意图所示。
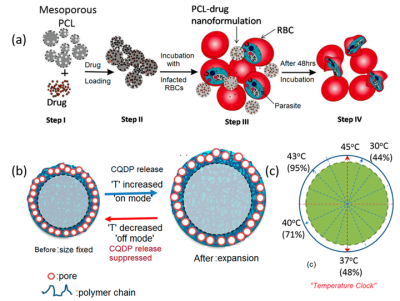
图5. (a) 抗疟药物制备和装载到介孔核壳聚合物纳米颗粒中的多个步骤,以及用受感染的红细胞进行治疗,(b) 纳米制剂的“开”和“关”模式,以及 (c)提出的“温度时钟”机制显示不同程度的释放随温度变化(来源:ACS Applied Bio Materials)。
4. 使用高分子纳米材料开发抗疟疫苗
尽管自1960年代以来已进行了许多尝试,但至今还没有获得许可的疟疾疫苗。疟疾疫苗接种方法的类型包括载体疫苗、全寄生虫疫苗、血液阶段疫苗、红细胞前期疫苗、蚊子阶段疫苗、传播阻断疫苗和联合疫苗。在此,我们强调了开发和应用由聚合物材料制成的抗疟疾疫苗的多种方法。 1987年,Verdini和他的研究小组首次尝试设计抗疟疫苗。他们试图设计一种含有天冬酰胺酰-丙氨酰-天冬酰胺酰-脯氨酸低聚物(DP,n≥10)的疟疾疫苗;然而它并不成功。
4.1. 基于蛋白质、肽和碳水化合物的疫苗接种方法
用于疫苗开发的肽-聚合物偶联系统是一种有吸引力的方法,与现有方法相比具有许多优势。葡聚糖、聚(牛血清白蛋白(BSA))和聚(卵清蛋白(OVA))用作载体聚合物,它们与肽缀合,例如恶性疟原虫的CSP(环子孢子蛋白)外壳蛋白和P. . berghei 菌株。葡聚糖与肽的偶联在没有佐剂的情况下产生最佳的每分子价和肽密度。这些携带者自己诱导 IgG 和 IgM 反应。免疫原性也随着蛋白质多样性的增加而增加。配制了由通过碳二亚胺与 BSA 缀合的伯氏疟原虫 CSP 重复表位 (DPPPPNPN)2-CS 组成的非离子嵌段共聚物。这些在小鼠模型中施用,肽-聚合物偶联物 (CS/BSA) 的不同比例为 55:1、6:1 和 170:1,并用活子孢子攻击。从IFA测量中观察到抗体-抗原结合类似于无菌免疫,在子孢子表面,IgG1同种型表现出凝集作用。得出的结论是,基于受抗体亲和力、同种型和特异性影响的无菌免疫诱导,CSP 可能是疟疾疫苗的潜在候选者。
海藻酸盐广泛用于免疫目的、微胶囊化和单核细胞/巨噬细胞刺激活性,并具有佐剂活性。与肽序列(例如,RGD)偶联的改性海藻酸盐也据报道能够通过靶向免疫细胞来增强抗原摄取和免疫反应,并可用于开发疫苗和预防疟疾感染。糖缀合物和合成碳水化合物也被报道为细胞间识别、受精、炎症、转移和免疫反应等生命过程中的重要材料。此外,这些聚合物还用于合成寡糖疫苗,以对抗热带疾病(例如疟疾)、细菌感染(例如肺结核)、病毒感染(例如HIV)和癌症。据报道,大量的糖基磷脂酰肌醇 (GPI) 在疟原虫细胞表面表达。疟疾死亡率和发病率是由GPI 产生的炎症级联反应引起的。该抗原是通过用连接到马来酰亚胺活化的载体蛋白上的接头处理合成的六糖疟疾毒素来制备的。在接种疫苗的小鼠(使用 GPI)中,60%–75% 的小鼠存活,而未接种疫苗的小鼠只有 0% 到 9%。因此,与载体蛋白缀合的 GPI 寡糖具有免疫原性,并且对疟疾寄生虫具有相当大的安全性。两种主要的抗疟疾传播阻断抗原 Pfs25 和 Pfs230D1 通过形成纳米颗粒分别与外蛋白 A(EPA,一种在动物研究中被证明是安全的重组载体蛋白)结合。与游离抗原相比,这些纳米颗粒显示出增强的免疫原性。由于 Pfs230D1 需要活性补体,Pfs230D1 比 Pfs25 更具免疫原性。自组装蛋白纳米颗粒 (SAN) 设计有恶性疟原虫环子孢子蛋白的表位和部分 toll 样受体 5 (TLR5) 激动剂鞭毛蛋白作为佐剂。据报道,这些 SAN 在疟原虫感染的小鼠模型中更具保护性并产生更高的免疫原性反应。最近开发的疫苗 RTS,S/AS01 是基于一种油水配方,其中含有一种免疫刺激剂和一种脂多糖衍生物。
4.2.基于纳米聚合物的基因工程疫苗
与其他生物分子相比,基于 DNA 的方法具有开发疟疾疫苗的巨大潜力,因为 DNA 的固有特性。根据用于诱导免疫的载体类型,DNA 疫苗可以诱导细胞和体液反应。阳离子聚合物 PEI 因其内溶成分而被广泛用于制造非病毒基因载体。 DNA 与 PEI 的缩合使流体动力学直径更小,并增加了与细胞膜的静电相互作用。PLGA,包埋 DNA,有助于在特定生理环境和质粒编码中持续释放 DNA。据报道,封装在 PLGA/PEI 中的 19 kDa 裂殖子表面蛋白 1 (MSP119) 片段的 DNA 在个体对疟疾的免疫中诱导入侵抑制反应。 (192) 因此,基于 PLGA-PEI-pDNA(质粒 DNA)的系统可能是用于管理疟疾的疫苗的良好元素。在这里 pDNA 与 PEI 浓缩并通过雾化过程加载。可以指出,虽然很多核酸与阳离子聚合物和阳离子脂质体结合用于临床,但阳离子复合物存在生物相容性低、细胞毒性强等主要缺点。也有报道称,用 γ-聚(谷氨酸)(γ-PGA)包被的 pDNA 表现出令人满意的基因表达,细胞毒性可忽略不计。基于这些结果,形成了用于疫苗设计的三元复合物,其中使用编码约氏疟原虫 MSP1、PEI 和 γ-PGA 的质粒并在 C57BL/6 小鼠中给药。
基因工程疫苗开发方法不仅适用于微米尺寸的颗粒,还用于纳米尺寸的载体以解决该问题。从多个结果(ELISA、IFA 和蛋白质印迹)得出的结论是,根据纳米颗粒包被的疫苗制剂,疫苗可以引发所需的抗体反应。Kodama 和他的同事开发了一种新的 pDNA 和阳离子聚 (l-赖氨酸) (PLL) 药物载体。然而,由于高细胞毒性和低基因表达问题,聚(l-组氨酸)(PLH)被添加到 PLL-pDNA 复合物中,这有助于增强基因表达。通过诱导 pH 缓冲效应,PLH 可以增加设计复合物的内体逃逸行为。此外,四元复合物(pDNA-PLL-PLH-γ-PGA 复合物)表现出低细胞毒性和高基因表达。类似地,当使用树枝状多聚(L-赖氨酸)(DGL)代替 PLL 时,形成了三元复合物(pDNA-DGL-γ-PGA 复合物),并表现出低细胞毒性和高基因表达。同一研究小组还尝试使用约氏疟原虫菌株 GPI8p-转酰胺酶相关蛋白 pDNA (PyTAM) 设计疟疾 DNA 疫苗,并再次配制了三元复合物 (PyTAM-DGL-γ-PGA)。通过体内疟疾模型,他们表明该系统显着增强了基因表达并增加了免疫小
4.3. 抗体-基于抗原的聚合物纳米载体
对于抗疟疾疫苗,聚合生物可降解微球 (MS)非常有效地证明抗体对包埋抗原的延长反应。这些也能够引起 T 细胞对天然蛋白抗原和合成肽的增殖反应。使用不同的MS制剂,来自伯氏疟原虫 CSA 蛋白的微小合成肽能够在不同的小鼠模型中诱导细胞毒性T淋巴细胞 (CTL) 反应。这些 CTL 本质上是抗原特异性的。当小鼠注射具有短CTL的MS或吸附在空的MS上时,与不完全弗氏佐剂 (IFA) 制剂相比,CTL反应增强。这表明 MS 具有传递抗原以增强CTL反应的效力。这种微囊化技术也有助于设计亚单位疫苗。 (202) 用来自恶性疟原虫裂殖子表面抗原、红细胞结合蛋白 (EBP)、MSA1 和 MSA2 的非重复和保守区域的肽合成了三个B表位。肽与GPG间隔物聚合形成含有半胱氨酸桥的均聚肽,并用于用设计的配方和明矾中的多种抗原肽免疫兔子。通过IFA和ELISA测定测量,研究了抗体反应。最后一次免疫后,IgG 水平维持23周,23周后IgM抗体消失。为了提高 SPf66 的免疫原性,使用亚微米大小的 PLGA 制成基于 MS 的递送系统并施用于小鼠,它显示出相当高的免疫反应。与明矾吸附的 SPf66 相比,它产生了更高的 IgG 水平。后来,这种合成肽被封装在 PLGA、50:50 和 75:25(乳酸/乙醇酸)亚微粒的组合物混合物中,并口服给予小鼠。对于接种PLGA 的小鼠,观察到IgG2a 同种型略有增加。因此,这是激活 Th1 样免疫反应和细胞免疫反应的标志。两种合成肽也取自恶性疟原虫FC27和3D7菌株的恒定区,封装在 PLGA 微粒中,并与 Montanide ISA 720(一种佐剂)一起递送。通过体内研究(在 C57BL 小鼠模型中),已经表明两种肽都产生了持续的抗体反应。有趣的是,与皮下给药途径相比,皮内给药途径诱导更好的免疫反应。后来,使用PLGA合成了一种模拟病原体的聚合物疫苗纳米颗粒,并用单磷酰脂质-A (MPLA) 包裹。此外,这与疟疾抗原VMP001结合,以检查对间日疟原虫子孢子的免疫反应。与具有MPLA的可溶性蛋白疫苗相比,这种疫苗接种的体内结果激发了具有高滴度值的持久抗原特异性抗体和增加的Th1/Th2反应。
4.4. 基于纳米脂质体和纳米聚合物体的疫苗接种方法
建议将基于载体的疟疾疫苗递送用于蛋白质抗原、pDNA/RNA 和抗原编码的亚单位疫苗,因为它们与聚合物微粒或纳米颗粒的递送表现出更强的免疫反应。科学家们试图设计一种采用佐剂方法的阻断传播的疟疾疫苗,其中Pfs25被封装在凝胶核心脂质体载体中,用于控制递送至免疫系统的细胞。使用脂质体作为疫苗载体的主要原因是表位易于包封和增强抗原呈递细胞 (APC) 的吞噬作用。但是由于它们的不稳定性和脂质体中负载的抗原的快速释放,它们的使用受到限制。为克服这些限制,设计了一种特殊的脂质体结构,在脂质囊泡内部,以凝胶或颗粒的形式开发了聚丙烯酸 (PAA) 的生物相容性聚合物核心。在该系统中,用脂质体的凝胶核进行免疫是非常有效的。肌肉注射脂质体制剂治疗疟疾后,与使用常规脂质体的 Pfs25 相比,免疫反应显着增加。因此,发现凝胶核心脂质体系统作为载体佐剂非常有效,可用于肌肉内递送基于重组抗原的阻断传播的疟疾疫苗。
聚合体由嵌段共聚物组成,可作为开发疟疾疫苗的载体。用于疫苗递送的多聚体的潜在优势是它们的机械稳定性和广泛的化学多功能性,可有效引入刺激响应药物或疫苗材料,或者也可用作纳米反应器。它们还显示出模拟细胞并在细胞内充当人造细胞器的能力。在某些情况下,两种或更多种不同的嵌段共聚物,例如,聚(2-甲基-2-恶唑啉)-b-聚(二甲基硅氧烷)-b-聚(2-甲基-2-恶唑啉) (PMOXA -b-PDMS-b-PMOXA;图6c) 和 PDMS-b-肝素 (图6d) 混合并形成纳米囊泡。这些囊泡可以模仿宿主细胞膜,并且可以像宿主细胞膜一样发挥作用,被发现可用于开发。如今,具有多种直径的聚合体,即巨型单层囊泡 (GUV),也可作为简化细胞模拟物的模型系统,有效预防疟疾感染(图6b)。
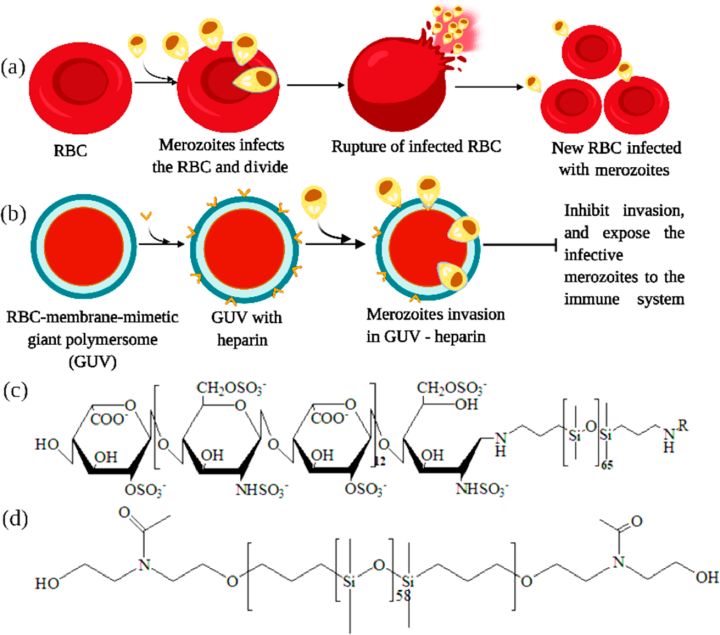
图6. (a) 裂殖子侵入红细胞和 (b) 基于聚合物的红细胞膜模拟纳米结构在进入新红细胞之前阻断裂殖子的代表性示意图。 (c) PDMS-b-肝素和 (d) PDMS-b-PMOXA-b-PDMS 的化学结构(来源:ACS Applied Bio Materials)。
还研究了使用模拟红细胞膜的聚合体抑制将受影响的裂殖子暴露于免疫系统的寄生虫入侵(即阻断疟原虫的生命周期)。这些RBC膜模拟物具有聚合体的空心球结构,并且能够以类似于纳米模拟物的方式结合蛋白质 PfMSP142。值得注意的是,这些RBC膜模拟型聚合物囊体呈圆盘状,直径约7 μm,由两种不同的嵌段共聚物制成。第二种嵌段共聚物含有 GUV 膜中的肝素型受体分子和寄生虫配体 PfMSP142。有趣的是,感染红细胞的恶性疟原虫裂殖子与红细胞膜的模拟物相互作用,即聚合体/嵌段共聚物,并使它们变形(图6b)。这种配方既可用作药物,也可用作候选疫苗。尽管这些配方是微米级的,但这些 GUV 可以成为小分子聚合体的合适模型,可以有效地相互作用和使受感染的红细胞变形,并且可能在疟疾感染的管理中具有潜力。
5. 疟疾诊断、药物和疫苗的科学专利信息
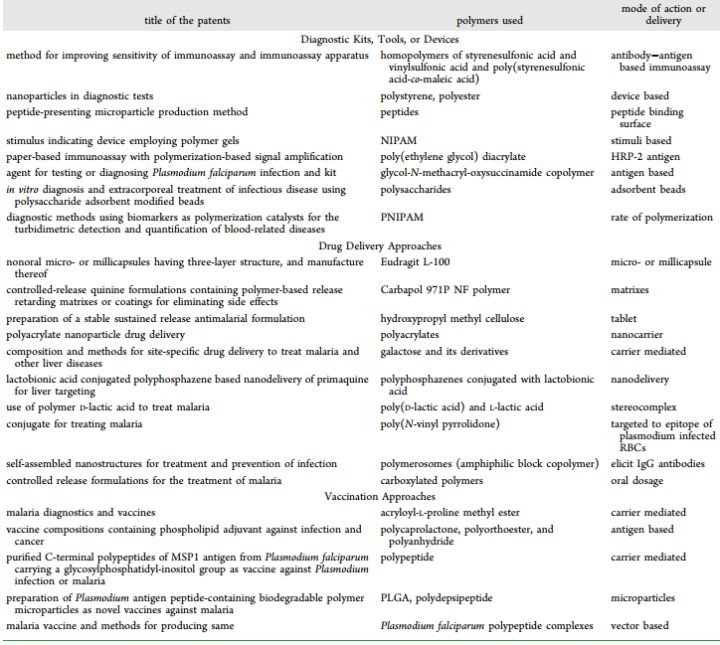
自1970年以来,世界各地已申请了多项用于疟疾诊断、疫苗接种和治疗的专利。首先,来自日本的一组科学家申请了专利,他们制备了一种含有有机化合物和二氢吡喃羧酸盐的基质,并在体内大鼠模型中检查了伯氏疟原虫菌株。源自丙烯酸或其盐的低分子量聚合物被用作疫苗佐剂来治疗各种感染和癌症。多环芳香酚用于抑制谷胱甘肽-S-转移酶 (GST),这是导致疟疾的主要原因。表2显示了在全球范围内提交的关于疟疾诊断试剂盒、药物输送工具和疫苗接种的多项专利。
表 2. 使用聚合物治疗疟疾的专利申请(来源:ACS Applied Bio Materials)
6. 用纳米聚合物治疗疟疾的各种方法
6.1. 核-壳聚合物-无机或聚合物-聚合物纳米粒子
对于疟疾的治疗,具有超顺磁性性质的氧化铁纳米颗粒被称为SPIONs(超顺磁性氧化铁纳米颗粒)。这些通过使用磁性药物递送技术(即磁转染)广泛用于非病毒和病毒载体的基因递送。这些也适用于使用 PEI 涂层 SPIONS 的低剂量基因转染,因为它们能够与 DNA 形成复合物(图7)。这些缩合产物可以防止通过核酸酶降解,并且还可以磁性靶向所需位点。释放机制如图7 所示。
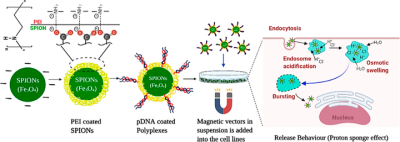
图7. 通过施加外部磁场逐步制备 PEI 涂层 pDNA 复合物和疟疾疫苗释放行为的代表性示意图(来源:ACS Applied Bio Materials)。
据报道,磁转染用于制备用约氏疟原虫裂殖子表面蛋白 MSP119 (VR1020-PyMSP119) 编程的疟疾疫苗。含有 MSP119 的质粒 DNA (pDNA),即 PyMSP119,与涂有不同摩尔比的PEI和DNA的 SPIONS 复合。与中性pH相比,SPION-PEI 复合物在pH 4.0下与 PyMSP119 的结合能力增强,此外,聚合物的化学结构有助于在特定 pH 下保护 DNA,从而提高转染效率。
同一组研究人员报告说,SPION 连同 PEI 和透明质酸 (HA) 也可作为类似疟疾 DNA 疫苗的载体。稳定性、表面电荷、载体大小以及结合和释放 DNA 的能力完全取决于组装顺序和设计配方。 DNase 敏感性测定表明,至少在30分钟内,编码 PyMSP119 的 pDNA 疫苗在所有排列中都保持其结构完整性而没有损坏。因此,具有 SPION 的聚合物材料对于提供疟疾DNA疫苗非常有用。
为了传递青蒿素,设计了核壳聚(己二酸丁二醇酯)-聚(乙烯基吡咯烷酮)纳米纤维,并用恶性疟原虫进行了体外试验。疏水核壳材料控制药物在水性介质中的释放和溶解度。报道了两种二线抗疟药(姜黄素和奎宁)的共同给药,它们被包裹在核壳聚合物纳米载体中,其中 PCL 是壳,辛酸/癸酸甘油三酯是核心。对特定的恶性疟原虫菌株 3D7 和 W2 进行了体外研究,使用这种纳米药物与两种药物的组合,与自由给药相比,显示出控制寄生虫感染的潜力。合成中空介孔铁氧体纳米粒子 (HMFNs) 并涂上肝素 (HEP) 以形成介孔壳。青蒿素(ART)被加载到核壳颗粒(HMFNs@ART@HEP)中,由于红细胞期疟原虫代谢产物中存在的HMFNs和疟原虫素之间的静电吸引力,实现了对感染红细胞的特异性靶向。这些制剂不仅干扰释放的裂殖子,而且有助于提高抑制效力。
6.2. 基于纳米聚合物的组合和共轭疗法
联合疗法是一种新的治疗方法,其中给患者服用一种药丸的组合,每种药丸都含有一种特定的药物,或者是一种含有多种药物的药丸。由于一线抗疟药耐药,联合治疗开始发挥作用。与具有不同作用模式的药物联合治疗可以克服药物再利用筛选挑战(264),随后降低单个药物浓度。
聚磷腈(图8a)是具有无机骨架的大分子,其中磷和氮原子通过交替的单键和双键连接,每个磷原子上有两个取代基。它们的物理和化学性质可以被广泛改变,它们可以作为抗疟药物输送的潜在候选者。为了靶向递送和增加肝细胞摄取,伯氨喹(喹啉的类似物)和双氢青蒿素(青蒿素的类似物)作为抗疟药效团与 4-乙酰氨基苯氧基取代的聚磷腈、2-丙氧基取代的聚磷腈、4-氨基乙基苯甲酸酯取代的聚磷腈结合, 和 4-甲酰基取代的聚磷腈并配制成纳米颗粒。高表面电荷导致纳米颗粒之间的强烈排斥,并以更高的稳定性避免聚集。这些制剂在伯氏疟原虫感染的小鼠模型中进行了测试,并在较长时间内表现出强大的防御能力,而不会重新激活疟疾菌株。后来,同一组研究人员将聚(有机磷腈)与相同的抗疟疾药物结合。与之前的报告相比,这些新配方显示出不同的降解速率和不同的释放速率。由设计的制剂引起的溶血百分比在静脉给药可接受的范围内,并且它们表现出~100%的抗疟活性。由 d-α-生育酚 PEG 和含有氯喹和多西紫杉醇的聚(环氧乙烷)-嵌段-聚(环氧丙烷)-嵌段-PCL (PEO-b-PPO-b-PCL) 组成的纳米胶束设计用于癌症和疟疾的联合治疗。体内结果显示受控释放速率和低溶血速率。负载姜黄素和青蒿琥酯的 PLGA NP 在伯氏疟原虫感染的小鼠模型中显示出更高的抗疟原虫活性和低毒性。根据体外研究,观察到5 mg剂量的抑制率在第5天为 79.0%,在第 8 天为 72.5%。有趣的是,与游离姜黄素或青蒿琥酯相比,这些制剂显示 10-30%在非常低的浓度下提高疟疾寄生虫的抑制效率。包裹atovaquone的固体药物纳米颗粒以及聚合物和表面活性剂的组合(聚合物 PVP30、PVA、PEG、羟丙基甲基纤维素 (HPMC) 和 PEO80-b-PPO27-b-PEO80·PVP30 和 PVA)制剂显示出对恶性疟原虫的良好预防活性。乙酰和琥珀酰改性 HPMC 聚合物和 PCL-b-PEG 嵌段共聚物用于提高 OZ439(一种合成抗疟药)的口服生物利用度。与自由给药相比,该制剂显示出具有增加的药物生物利用度的持续释放。PLGA NPs 也用于 CQ 与抗生素阿奇霉素的共同递送,以获得更好的疗效。一种载有双膦酸盐和铂 (II) 复合物的水溶性聚天冬酰胺载体在疟疾治疗中也表现出很高的疗效,与小剂量抗癌药物联合使用时,抗疟活性会有所不同。低剂量的抗癌药物会使寄生虫的防御能力失活,因此它是对抗耐药性问题的新机会。一种基于聚天冬酰胺的纳米载体,用于双联抗疟药物(如乙酰二茂铁(二茂铁衍生物)和 (N-(7-chloroquinolin-4-yl)propane-1,3-diamine)(一种氯喹类似物))递送研究过。乙酰二茂铁的释放非常好,动力学值(n 值)从 1.16 到 1.34 的顺序,对于氯喹类似物,它是案例 II,n 值从 1.06 到 1.12。总体而言,这些基于聚天冬酰胺的纳米药物可用于抗疟药与低剂量抗癌药的组合,以解决与一线抗疟活性相关的耐药性问题。
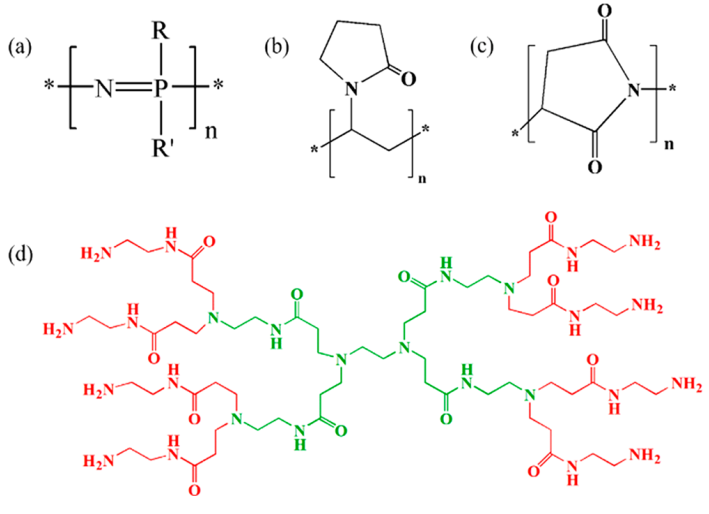
图 8. (a) 聚磷腈、(b) 聚(乙烯基吡咯烷酮)、(c) 聚天冬酰胺和 (d) 聚(酰胺基胺)(树枝状大分子,第 1 代(绿色)和第 2 代(红色))的化学结构)(来源:ACS Applied Bio Materials)。
由于程序性药物释放、改善药代动力学和药效学行为、对正常细胞的毒性较小以及通过肾脏过滤消除等益处,聚合物-药物偶联物在疟疾的治疗中也发挥着重要作用。 PVP、PGA、PLGA、PEG 和天然可生物降解聚合物(图8b)是用于制备聚合物-药物偶联物的主要聚合物。由于水溶性、多种生物活性剂的包封、生物降解性和锚定位点的可及性等多种特性,这些被用作结合治疗中的药物载体。测试了与硫代磷酸酯反义寡脱氧核苷酸缀合的壳聚糖纳米粒子抗疟疾拓扑异构酶 II 基因,结果显示恶性疟原虫 K1 菌株的生长减少。与表面带正电荷的纳米粒子相比,表面带负电荷的纳米粒子对寄生虫生长的抑制作用更强。这项研究是首次尝试使用纳米颗粒对恶性疟原虫进行反义治疗。与氯喹和伯氨喹等抗疟药结合的阳离子(AGMA1 和 ISA1)和阴离子(ISA23)聚酰胺胺(图8d)也在约氏疟原虫感染的小鼠中进行了测试,显示出比自由给药更好的结果。此外,同一组研究人员还研究了使用带有精氨酸单元 (ARGO7) 的阳离子聚(酰胺基氨基酸)的CQ口服给药。对含有氨基喹啉的聚酰胺胺偶联物针对耐氯喹的恶性疟原虫进行了测试。由于存在 3-二乙胺-1-丙胺单元,与自由施用氨基喹啉相比,该缀合物显示出更好的抗疟原虫作用。许多抗疟药(例如,磺胺多辛、乙胺嘧啶、氯喹)与聚天冬酰胺中的抗生素(4-氨基水杨酸)结合(图8c)对寄生虫的无性血期表现出有希望的抗疟活性。与游离抗叶酸剂相比,乙胺嘧啶和磺胺多辛缀合物显示出良好的抗疟原虫活性。尽管与 4-氨基水杨酸和抗生素的缀合物对无性恶性疟原虫没有活性,但当它们与选定的抗疟药包封在聚合物载体中时是有效的。
7. 发达的动物模型:治疗疟疾的重要前提
为了成功发现候选药物或疫苗,制剂必须通过体内研究(干预微生物和宿主两者)以评估物理后果。为了推进临床和临床前研究的候选者,非常需要新的策略、快速且具有成本效益的筛选,以及选择有前景的工具。对于疟疾治疗,使用C57BL/6或CBA/T6菌株作为标准小鼠模型。约氏疟原虫和伯氏疟原虫是常用的寄生虫,因为它们具有红细胞前免疫,而对于脑型疟疾,大多数柏氏疟原虫 ANKA 模型是临床前阶段测试的标准小鼠模型。由于伦理和后勤问题,小动物模型或人源化小鼠模型 (HMM) 已发展成为有效抗疟候选药物临床前测试的重要方法。Ng和他的同事使用PEG支架开发了一种具有嵌合肝(人异位人工肝)的 HMM。对于疟疾复发病例的体外研究,使用3D球体培养原代肝细胞开发了疟疾阶段肝模型。最近,一组科学家开发了一种人源化小鼠模型,用于间日疟原虫从肝脏阶段到血液阶段的感染和过渡。同样,设计了几个血脑屏障模型和一个视网膜模型来分别研究血红素介导的脑损伤和与脑疟疾相关的视网膜病变。成功的动物模型绝对需要以最小的副作用将产品推向市场。
8. 抗疟药物开发的临床和临床前状态
2018年7月 20日,Medicines for Malaria Venture (MMV) 和葛兰素史克 (GSK) 报告称,美国 FDA 已批准单剂量 Krintafel(他非诺喹),可用于16 岁或以上感染间日疟原虫的疟疾患者进行预防疟疾复发。据WHO称,RTS,S/AS01 (RTS,S) 是唯一成功的先进候选疫苗,其试点研究于 2019 年4月23日开始。截至 2020年11月15日,已在全球范围内接种了100万剂疫苗。加纳、肯尼亚和马拉维等试点国家和近48万名儿童在儿童时期接种了第一剂疫苗。图9列出了仍在进行临床前和临床试验的其他有效药物和候选疫苗。
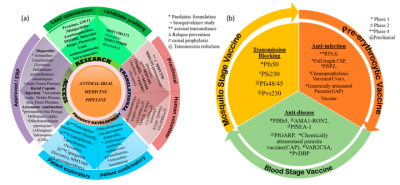
图9. (a) 抗疟疾药物和 (b) 抗疟疾疫苗的临床和临床前状态(来源:ACS Applied Bio Materials)。
9. 讨论和未来方面
自发现疟疾寄生虫140年后,经典的治疗(常规药物)和预防(疫苗接种)方法仍未能消灭疟疾。缺乏临床和临床前数据、对产品免疫贡献的信息不足以及大规模生产的高成本大大降低了开发的进展。进展似乎停滞不前。过去几十年的成果表明,只有全世界团结起来,疟疾治疗才有可能取得成功。如果能够开发出合适的候选药物或疫苗来阻止寄生虫的传播,并提高疗效,全球疟疾根除政策可能会受益。
然而,与常规疟疾化疗相关的主要缺点包括非特异性靶向或将单一或多种药物递送至细胞内寄生虫,这会对特定器官造成无法耐受的毒性。与其他纳米粒子系统相比,基于聚合物的纳米载体具有许多优势,因为它们具有增强的生物利用度、良好的生物相容性、改进的药物装载和释放能力,以及降低的毒性,并且还解决了与耐药行为相关的缺点的抗疟药。除此之外,尽管聚合物纳米粒子(如水凝胶、树枝状大分子、胶束、脂质体和缀合物)由于其尺寸、固体形式和易于多次修饰的优势而有效地递送药物,但仍然存在许多限制。具有高CMC 的胶束会迅速解离并在血液中引起稀释效应,其制备也需要选择合适的合成化学水平高的聚合物。与纳米脂质体相关的主要问题是它们需要昂贵的合成程序,并且在降解过程中可能释放大量药物,从而导致高毒性。对于聚合物-药物偶联物和联合疗法,高成本、较差的生物利用度、载药能力和不同的药代动力学特征是主要限制。在树枝状大分子的情况下,交联剂的选择是一项艰巨的任务。 因此,通过关注这些挑战,可以采用新的和改进的方法来设计聚合物纳米载体,以更好地递送抗疟药。
由于疟原虫在体内有一个内在的时钟,可以预期刺激响应聚合物纳米载体(即温度-时间依赖性)将被更多地探索,以开发一种合适的疟疾治疗方法。2018年,Dr. Paik也提出了类似的方法。Paik博士及其团队发明了一种独特的中空介孔聚合物胶囊,用于治疗脑型疟疾;恶性疟原虫对所有抗疟药物都有耐药性,这对脑型疟疾的治疗提出了挑战。这种纳米药物通过靶向受感染的红细胞并在发热周期中溶解其中的恶性疟原虫来根除恶性疟原虫。这种个性化的时间-温度调制纳米药物对改善脑型疟疾具有独特的作用。
在过去的四十年里,红细胞在镰状细胞性贫血、白血病、糖尿病和糖尿病前期病例中充当了生物制剂、药物和纳米颗粒的超级载体,但特别是对于疟疾,这种技术很少被利用。与该技术相关的主要挑战是红细胞的来源、储存、化学修饰程度以及循环和治疗效果。通过解决与红细胞携带者相关的这些缺点,可以产生一种新的有效治疗方法。从之前的基因分型研究中,还可以表明,与地理相关的疟原虫变异(遗传异质性)可以通过载有靶向基因的基于肽/聚合物的纳米载体来解决。
在用于治疗脑型疟疾的疫苗开发中,聚合物纳米颗粒可以发挥重要作用,并有助于有效地传递抗原、基因DNA 分子,但不幸的是,聚合物并未在该领域得到充分利用。然而,在严重的疟疾病例或疟疾流行地区,静脉注射疫苗将是最佳选择。预防疟疾感染的其他可能性正在增加蚊帐的使用和快速诊断工具的可用性,特别是在疟疾流行地区。尽管全球各地已申请了大量专利(见表2),但迄今为止,尚无疫苗可用于商业化。最近,许多免疫信息学(计算方法与实验免疫学相结合以开发算法)方法已被用于预测疟疾抗原的免疫原性,并用于设计抗疟疾的抗原表位和多亚单位疫苗。这些方法主要基于氨基酸序列或蛋白质结构水平。因此,通过在恶性疟原虫生命周期的正确阶段应用基于聚合物的纳米药物,可以提高治疗效率。
据世卫组织称,由于COVID-19的爆发,2020年疟疾 GTS(2016-2030 年全球疟疾技术战略)里程碑并未在全球范围内实现。疟疾诊断和治疗出现了巨大的中断(图10)。尽管医学领域的国际合作、创新和发展提高了有效治疗脑型疟疾的能力和分子水平对病因的了解,但仍需要深入分析整合新疗法的寄生虫学、流行病学、市场战略和社会影响和方法。
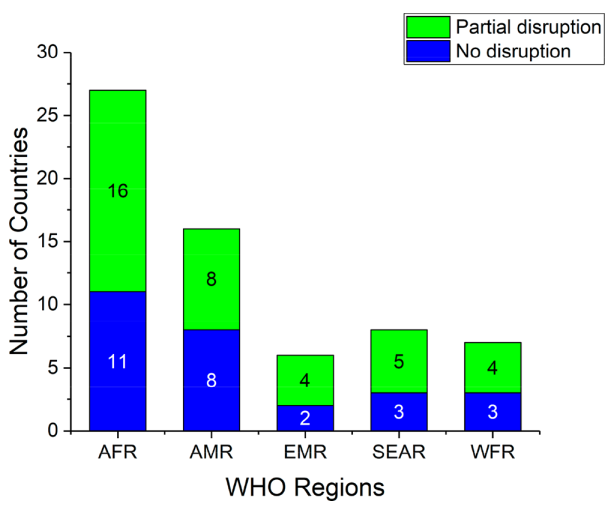
图10. 根据世卫组织发布的《2020 年世界疟疾报告》,关于因 COVID-19导致疟疾诊断和治疗中断的调查。缩写:AFR,WHO非洲区域; AMR,世卫组织美洲区域; EMR,世卫组织东地中海区域; SEAR,世卫组织东南亚区域; WPR,世卫组织西太平洋区域(来源:ACS Applied Bio Materials)。
10. 总结
为了提供新的见解和知识并优化治疗程序,本文广泛描述了基于聚合材料和纳米药物的各种诊断工具或设备、纳米载体和疫苗。本综述中的例子表明,聚合物纳米药物在治疗脑型疟疾方面的应用较少。不管现有的方法和技术如何,毫无疑问,可以说通过现有方法与新的创新相结合,在这个领域有巨大的挖掘空间。预计本综述将有效地导致对脑疟疾治疗的更好理解,并将为使用不同形式的聚合物纳米材料的诊断、耐受性良好和有效的治疗程序以及疫苗接种的可能演变提供新的策略。
参考文献
Patra, Sukanya, et al. "Polymeric nanoparticle based diagnosis and nanomedicine for treatment and development of vaccines for cerebral malaria: a review on recent advancement." ACS Applied Bio Materials 4 (2021): 7342-7365.




